![]() Časopis BIOM, články a sborníky | Domovská stránka
Časopis BIOM, články a sborníky | Domovská stránka ![]()
Testování biodegradability (1997)
Biodegradace je ovlivňována zejména těmito vlivy prostředí: teplota, světlo, živiny, pH, vlhkost a přítomnost kyslíku. Biodegradace je většinou zapříčiněna enzymy produkovanými mikroorganismy, ale podporují ji i další procesy, např. abiotická hydrolýza, fotodegradace, mechanické narušení apod. Mikrobiální aktivita mění zároveň strukturu látek kultivačního média. V anaerobních podmínkách dochází většinou ke snížení pH vlivem organických kyselin produkovaných mikroorganismy. Naproti tomu v aerobním prostředí může pH i vzrůst (při kompostování dochází obvykle ke zvýšení pH na 8-9) (Golueke 1991). Vlivem ohromných rozdílů v přírodních podmínkách biodegradabilita polymerů silně kolísá jak v globálních měřítcích, tak i v rámci malého ekosystému. To je mimo jiné zapříčiněno i druhy mikroorganismů vyskytujících se v dané lokalitě. Při testování by podmínky prostředí měly být udržovány co možná nejstandartnější a nejkonstantnější, aby byla zajištěna spolehlivost a reprodukovatelnost výsledků.
Biodegradabilita prvních biodegradovatelných plastů byla testována metodami vyvinutými pro studium schopnosti plastů odolávat mikrobiálnímu napadení (Seal a Pantke 1986). Tyto testy byly posléze nahrazeny metodami, které stanovují koncové produkty mikrobiálního metabolismu. Aby bylo vyhověno všem požadavkům na testování biorozložitelnosti plastů, byla vyvinuta řada metodik pokrývajících téměř celé spektrum prostředí ve kterých plasty po jejich upotřebení končí. Některé z nich jsou zakresleny do schématu na následujícím obrázku.
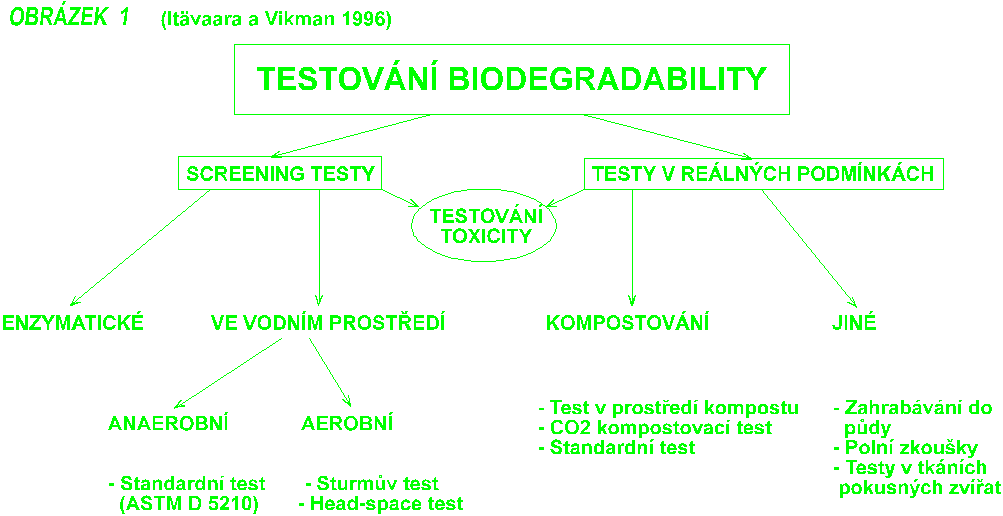
Testy ve vodním prostředí simulují aerobní i anaerobní podmínky na skládce domovních odpadů, ale jsou také použitelné jako screening testy. Jejich hlavními výhodami jsou nízká cena a možnost zkoušet najednou více polymerů. Jestliže je však předpoklad, že plasty skončí v půdě či na kompostu, pak je vhodné přidat ke standardnímu inokulu z čistírenských kalů mikroorganismy z půdy či kompostu (Müller et al. 1992).
Konečné produkty biodegradace, které se stanovují v těchto testech jsou u aerobní degradace CO2 a H2O a u anaerobní CH4, CO2 a H2O. Nulová biodegradabilita plastu zjištěná při testech ve vodním prostředí neznamená, že se tyto plasty nebudou rozkládat v jiných podmínkách např. při kompostování.
Příkladem kontrolovaného přirozeného aerobního rozkladu ve vodním prostředí je aerobní čištění odpadních vod. Anaerobní biodegradace se vyskytuje v říčních či jezerních sedimentech, na skládkách, anaerobních čistírnách odpadních vod apod. V půdě a na kompostech se většinou jedná o kombinaci aerobní a anaerobní degradace.
Podle standardních metod (ASTM D 5209, D 5210, D 5271, D 5338, D 5511, D 5526) se stupeň biodegradability stanovuje dle produkce koncových produktů mikrobiálního metabolismu a to v procentech teoreticky dosažitelného množství. Teoretické (maximální) množství mikrobiálních metabolitů můžeme vypočíst dle molekulárního složení plastů nebo stanovit analyticky.
Když je zapotřebí přesně sledovat dráhy produktů biodegradace, používá se značených atomů C-14.
Enzymatické testy mohou být použity jako screening testy tehdy, když je známa struktura polymeru a enzymy specifické pro daný polymer jsou dostupné. U materiálů na bázi škrobu, které byly studovány enzymatickými testy, bylo dosaženo srovnatelných výsledků jako u jiných metodik (Vikman et al. 1995a a Vikman et al. 1995b).
Předpovězení postupu rozkladu polymeru v přirozeném prostředí je obtížné a proto se používají testy v kompostech, polní pokusy, zahrabávání do země atd.
Před uvedením nové chemikálie na trh jsou vyžadovány ekotoxikologické testy (Bourdeau et al. 1990). Screening test toxicity by měl být také proveden na konci testování biodegradability, jelikož v průběhu rozkladu vznikají nové sloučeniny. Používá se např. Earthworm acute toxicity test OECD 207.
Screening testy
Sturmův test (OECD 301B, ASTM D 5209)
Sturmův test je velmi vhodná metoda pro měření biodegradability ve vodě rozpustných i nerozpustných sloučenin ve vodním prostředí. Kontinuální aerace zabezpečuje dostatek kyslíku uvnitř bioreaktoru. Měření v průběhu degradace uvolňovaného CO2 zprostředkovává okamžitou informaci o biokonverzi uhlíkatého řetězce polymeru na konečné metabolické produkty a to lépe než testy založené na určování spotřeby kyslíku, jelikož kyslík je využíván také při nitrifikaci (van Ginkel a Stroo 1992) nebo chemické oxidaci.
Sturmův test má také několik slabin, např. úniky plynů z velmi komplikovaného systému propojovacích hadiček mohou zavinit chybně nízké hodnoty produkce CO2. Oxid uhličitý je zachycován v roztoku hydroxidu barnatého, který je pak titrován jako funkce času. Pracnost metody byla hlavní příčinou pro vyvinutí automatického zařízení pro stanovování CO2 (Itävaara a Vikman 1996).
Testování biodegradability v tomto automatickém přístroji je založeno na měření změn elektrické vodivosti základního roztoku. Vodivost je kalibrována tak, aby výstupní hodnoty znázorňovaly množství uvolňovaného CO2. K přístroji může být simultánně připojeno 24 a v případě nutnosti až 80 bioreaktorů. Před započetím testu je třeba zadat do počítače teoretické množství CO2, které může být ze vzorku vyprodukováno. Počítač pak během testu kreslí kumulativní křivku uvolněného CO2 jako procento maximálního teoretického množství.
Head-space test (Itävaara 1995)
Když je z důvodu statistického zpracování potřeba testovat najednou velké množství stejných vzorků, pak je vhodné použít některý ze screening testů založených na stanovování CO2 v uzavřených baňkách s aerovaným médiem obsahujícím minerální živiny a inokulum mikroorganismů např. head-space test, který je založen na stanovování oxidu uhličitého v plynné a kapalné fázi. Dále je možno stanovovat biomasu mikroorganismů (do které bývá naasimilováno dle Raghavana et al. (1993) významné, zatímco podle Itävaary (1995) zanedbatelné množství CO2) například pomocí určení dehydrogenasové aktivity (Lopez et al. 1986), ATP (Holm-Hansen 1973), DNA (Hund et al. 1994), fosfolipidů (Frostegĺrd et al. 1991), ergosterolu (Gardner et al. 1993), intracelulárních proteinů (Itävaara a Vikman 1995), sušiny mikroorganismů (Itävaara a Vikman 1995) apod. Při provádění obdobných experimentů je nutné dodržovat velmi pečlivě standardní podmínky, jelikož mikroorganismy většinou velmi citlivě reagují na změny nutričních či jiných fyziologických podmínek.
Anaerobní degradace (ASTM D 5210)
V průběhu této biodegradace nejprve acidogenní bakterie štěpí organické látky na nižší metabolické intermediáty, jako jsou alkoholy a nižší mastné kyseliny. Tyto sloučeniny jsou dále degradovány acetogenickými bakteriemi na acetát, CO2 a H2. Po dokončení anaerobního rozkladu zůstávají jako konečné produkty CH4 a CO2, které jsou využity pro určení stupně degradace polymeru (Pagga a Beimborn 1993). Na kompletní biodegradaci polymeru je zapotřebí smíšená kultura mikroorganismů.
TESTY V REÁLNÝCH PODMÍNKÁCH
Kompostování jako proces biodegradace
Kompostování je biooxidativní proces, ve kterém jsou organické látky postupně rozloženy až na CO2, vodu, minerální soli a humus (Garcia et al. 1991 a Nakasaki et al. 1990). Průběh kompostování je určován aktivitou a druhy mikroorganismů. Teplota (která může dosáhnout i tak vysokých teplot, že dojde k samovznícení) by neměla překročit 60°C. Teplo vzniká důsledkem metabolické aktivity (Liymana et al. 1994). pH obvykle v průběhu kompostování stoupá nad 8 a pak opět postupně klesá přibližně na 7. To je ovšem závislé zejména na množství přítomného O2 a na vlhkostním režimu kompostu. Poměr C/N je důležitý pro rozvoj mikroorganismů. Měl by být udržován v mezích 20-40 (Baca et al. 1992). Váňa (1994) udává optimální poměr C/N na začátku kompostování 30-35/1 a pro vermikompostování 20/1. Poměr C/N se během správně prováděného kompostování snižuje, což závisí na množství organického uhlíku přeměněného do formy CO2 a míře denitrifikace. Velikost částic substrátu určuje rozlohu povrchu přístupnou pro mikroorganismy. Společně s vlhkostí má také vliv na množství vzduchu v kompostu, a tím na zásobu kyslíku.
Způsobilost mikroorganismů degradovat organické materiály je závislá na intenzitě s jakou produkují pro daný substrát specifické extracelulární enzymy. Vliv na rychlost rozkladu má také přístupnost materiálu pro enzymy (velikost vnitřních povrchů), chemické složení, struktura a konformace makromolekul apod. Kompostování je doporučováno jako nejvhodnější způsob využití biodegradabilních obalových materiálů a polymerů (Narayan 1994).
Test v prostředí kompostu (Itävaara a Vikman 1996)
Tento test je zaměřen na porovnávání biodegradability různých plastů v průběhu kompostování. Stupeň zkompostování je určen dle úbytků hmotnosti vzorků. Substrát je tvořen bioodpadem. Během kompostování je měřena teplota, pH, relativní zásoba O2 v kompostu a produkce CO2 (Jeris a Regan 1973). Kompostéry jsou umístěny v rámu tak, že najednou může být ve stejném prostředí měřeno deset sérií o čtyřech vzorcích. Do testu by se měla zahrnout známá biodegradabilní pozitivní kontrola (samotná celulóza, škrob atd.). Vyhodnocení testu se provádí každý týden vizuálně (při “překopávce” kompostů) a na konci testu zvážením a případnými dalšími chemickými, mechanickými či fyzikálními testy. Podmínkou je, aby na konci kompostovacího procesu byla pozitivní kontrola zcela rozložena a teplota uvnitř bioreaktorů poklesla na teplotu okolního vzduchu.
Paralelně s testem se provádí měření vlivu zvýšené teploty a pH na testovaný polymer z roztoku pufru.
Standardní kompostovací test (ASTM D 5338, CEN Draft)
Tato metodika je založena na měření produkce CO2 ve vzorku. Dvou až pětilitrové baňky jsou naplněny vyzrálým kompostem a vzorkem plastu (ve formě proužků, granulí, prášku apod.) v poměru 6:1 v přepočtu na sušinu a jsou ohřívány z vnějšku. Metoda ASTM určuje teplotní profil (1. den 35°C, 2.-5. den 58°C, 6.-28. den 50°C a 29.-48. den 23°C), zatímco CEN konstantní teplotu 58°C. CO2 se buď zachycuje v Ba(OH)2 a následně titruje, nebo se měří pomocí plynového chromatografu. Vedle pozitivní kontroly se pracuje i s negativní kontrolou (čistý PE) a s nulovou kontrolou (pouze kompost). Tento test znázorňuje nedostatečně reálný proces kompostování.
CO2 kompostovací test (Itävaara a Vikman 1996)
Tento test je také založen na stanovení CO2 vzniklého při kompostování, ale teplota není udržována uměle, nýbrž je výsledkem přirozené mikrobiální aktivity. V průběhu testu je určována teplota a pH a po jeho ukončení se doporučuje změřit poměr C/N, NH4, NO3, NO2, sušinu, spalitelné látky a humifikaci.
Test v prostředí vermikompostu
Stanovování biodegradability plastů sestávajících ze směsi lehce a obtížně biodegradovatelných makromolekulárních látek (např. PE+škrob, PE+celulóza ...) na základě stanovování produkce CO2 je velmi nespolehlivé, jelikož množství CO2 vzniklého při degradaci plastu je zanedbatelné oproti množství CO2 z rozkladných procesů ostatního substrátu. Obdobně i úbytek hmotnosti je stanovitelný jen s malou statistickou významností. Proto při zkoumání biodegradovatelnosti těchto plastů je výhodnější měřit změny fyzikálních vlastností v závislosti na době degradace. Abychom zajistili co možná nejintenzivnější a nejkomplexnější mikrobiální osídlení substrátu po co možná nejdelší dobu za konstantní teploty, vlhkosti a pH, zvolili jsme jako substrát pro biorozklad namísto klasických kompostů vermikompost. Ve vermikompostu jsou všechny vyjmenované parametry prostředí udržovány činností dešťovek (v našem případě druhu Eisenia fetida).
V našich testech používáme substrát ze směsi primárního papírenského kalu (PPK) a sekundárního papírenského biokalu (SPB) v poměru 1:1 v přepočtu na sušinu, vlhkosti 75-80%, pH okolo 7 a při teplotě 23°C. Míru biodegradability určujeme dle úbytků na hmotnosti plastů a změn těchto fyzikálních konstant: mez pružnosti, horní a dolní mez kluzu a napětí při přetržení.
Stručný popis etap, přes které jsme dospěli k naší metodice stanovování biodegradability plastů
V prvních pokusech jsme hledali optimální složení substrátu z tuhých odpadů celulózo-papírenského průmyslu pro vermikompostování. Zkoušeli jsme směsi s různými poměry SPB, PPK, smrkové kůry a zelí (odpad vzniklý při výrobě dřevoviny). Vermikompostovatelnost jednotlivých směsí jsme určovali podle úbytků na hmotnostech substrátů, váhových přírůstků dešťovek a počtu kokonů vzniklých během experimentu. Zatímco kůra a zelí se ukázaly být nevhodné pro vermikompostování, tak směsi SPB s PPK v poměrech 50/50 a 75/50 vykazovaly vysoké hodnoty vermikompostovatelnosti (Slejška 1996). Pro aplikaci těchto kalů pro průmyslové vermikompostování je však nutno dořešit způsob eliminace těžkých kovů ze substrátu (zejména Cd a Zn).
V dalším pokusu jsme stanovovali stupeň biodegradace sulfátového běleného papíru po třech týdnech v prostředí vermikompostu (s parametry uvedenými v předchozí kapitole) v závislosti na místě uložení v bioreaktoru. V podstatě šlo o kalibraci testu pro určování biodegradability plastů. Stupeň biodegradace jsme stanovovali dle úbytků pevností proužků papíru, které byly zašity v polyamidových síťkách a rovnoměrně rozmístěny po celém bioreaktoru. Zjistili jsme, že ve vrchních vrstvách vermikompostu probíhají rozkladné procesy intenzívněji než v hlubších vrstvách. To je pravděpodobně dáno snadnějším přístupem vzduchu a také tím, že E. fetida je nejaktivnější blízko povrchu. Závislost stupně degradace papíru na umístění po délce či šířce vermikompostéru, ani na druhu použité síťoviny jsme nenašli. Z těchto zjištění pro naše další experimenty vyplynulo, že musíme vždy zachovávat pro všechny vzorky stejnou hloubku uložení v bioreaktoru.
V nyní rozpracovaném experimentu, který se již blíží ke konci, stanovujeme biodegradovatelnost PE s přídavkem 4% rozemletého novinového papíru frakce do 0.25 mm oproti samotnému PE a EKOFOLu (PE + 12% škrobu). Biodegradabilitu určujeme dle změn meze pružnosti, horní a dolní meze kluzu, napětí při přetržení a hmotnosti v závislosti na době uložení ve vermikompostu. Z doposud získaných výsledků je možno usoudit, že nejrychleji se rozkládá EKOFOL, čistý PE se nerozkládá vůbec a PE se 4% papíru nevykazuje statisticky významné změny. Proto začínáme nový pokus, ve kterém významně prodloužíme dobu biodegradace (v současném pokusu jsme měli série vzorků uložené v bioreaktoru na 0, 3, 6, 9 a 18 týdnů, v nyní začínajícím budou doby vermikompostování 0, 2, 4, 6 a 9 měsíců). Toto prodloužení doby vermikompostování si vyžádá odlišný způsob ošetřování pokusu (jinou metodu přidávání substrátu apod.) a i zdokonalenou metodiku stanovování úbytků hmotností vzorků (hmotnosti nečistot pevně lpících na plastu, které způsobují chybně nízké hodnoty úbytků hmotností, se pokusíme vyčíslit pomocí změn v transparenci (průhlednosti) vzorků plastů během rozkladných procesů).
Seznam literatury
BACA,M.T.; FORNASIER,F.; de NOBILI (1992): ): J. Ferment. Bioeng. 74, 179-184.
BOURDEAU,P.; BUTLER,G.C.; CALAMARI,D.; GILLETT,J.W; LANDA,V.; PEAKALL,D.; SHEEHAN, P.; PERSOON, G.; TRUHAUT,R.; WELLS,P. (1990) in BOURDEAU,P.; SOMERS, E.; RICHARDSON,G.M.; HICKMAN,J.R. (Eds.): Short-term toxicity tests for non-genotoxiceffects, scope 41, IPCS joint symposia 8, SGOMSEC 4, John Wiley & sons, UK, s. 49-55.
FROSTEGĹRD,Ĺ.; TUNLID,A; BĹĹTH,E. (1991): J. Microbial. Methods 14, 151-163.
GARCIA,C.; HERNANDEZ,T.; COSTA,F. (1991): Environ. Manag. 15, 433-439.
GARDNER,R.M.; TINDALL,G.W.; CLINE,S.M.; BROWN,K.L. (1993): J. Microbial. Methods 17, 49-60.
GOLUEKE,C.G. (1991): The art and science of composting, JG Press, Emmaus, PA, pp. 14-39.
HOLM-HANSEN,O. (1973): Bull. Ecol. Res. Comm. 17, 215-222.
HUND,K.; GROLMS,U.; BÜNEMANN,T. (1994): Chemosphere 28, 813-823.
ITÄVAARA,M.; VIKMAN,M.; (1995): připravováno do tisku.
JERIS,J.S.; REGAN,R.W. (1973): Compost Sci. 14, 10-15.
LIYMANA,K.; STONE,B.A.; MACAULEY,B.J. (1994): Appl. Environ. Microbiol. 60, 1538-1546.
LOPEZ,J.M.; KOOPMAN,B.;BITTON,G. (1986): Biotech. Bioeng. 17, 1080-1085.
MÜLLER,R.J.; AUGUSTA,J.; PANTKE,M. (1992): Material Organismen 27(3), 179-189.
NAKASAKI,K.; YAGUCHI,H.; SASAKI,Y.; KUBOTA,H. (1990): J. Ferment. Bioeng. 70, 431-433.
NARAYAN,R. (1994) in VERT,M.; FEIYEN,J.; ALBERTSSON,A.; SCOTT,G.; CHIELLINI,E. (Eds.), Biodegradable plastics and polymers, Redwood Press, Melksham, Wiltshire, UK, s. 261-273.
PAGGA,U.; BEIMBORN,D.B. (1993): Chemosphere 27, 1499-1509.
RAGHAVAN,D.; WAGNER,G.C.; WOOL,R.P. (1993): J. Environ. Polym. Degrad. 1, 203-211.
SEAL,K.J.; PANTKE,M. (1986): Material Organismen 21(2), 151-156.
SLEJŠKA,A. (1996): Vermikompostovatelnost tuhých odpadů z celulózo-papírenského průmyslu. V příloze ke sborníku k semináři KOMPOSTY-BIOHNOJIVA-BIOPREPARÁTY 1996.
van GINKEL,C.G.; STROOC.A. (1992): Ecotoxicol. Environ. Saf. 24, 319-327.
VÁŇA, J. (1994):Výroba a využití kompostů v zemědělství. Institut výchovy a vzdělávání Mze ČR v Praze, Agrodat, 40 s.
VIKMAN,M.; ITÄVAARA,M.; POUTANEN,K. (1995a): J. Macromol. Sci. Pure Appl. Chem. A32, 863-866.
VIKMAN,M.; ITÄVAARA,M.; POUTANEN,K. (1995b): J. Environ. Polym. Degrad. 3, 23-29.